柳田 素子
京都大学医学研究科 腎臓内科学
班員プロフィール

柳田 素子
京都大学医学研究科 腎臓内科学 教授。
京都大学医学部医学科卒、2001年医学博士取得。
ERATO柳沢オーファン受容体プロジェクト研究員、京都大学医学研究科21世紀COE准教授、「白眉プロジェクト」特定准教授等を経て、2011年より現職。
Elected Member of American Society of Clinical Investigation、京都大学高等研究院ヒト生物学高等研究拠点主任研究者兼任。
研究内容
当グループでは高齢者の腎臓や移植腎などの腎臓病に形成される「三次リンパ組織」という炎症性病変の病態・臨床的な意味について研究を進め、新しい知見を積み重ねてきました。
また、腎臓における老化細胞のふるまい・性質についても研究を行っています。
(1) 腎臓における炎症誘発細胞の同定と機能解析
① 腎三次リンパ組織は高齢腎の障害後に形成し、炎症を誘発し、腎障害を増悪する
慢性腎臓病、末期腎不全の患者は増加傾向であり、その対策は社会的・医療経済的に重要な課題です。特に、高齢者は急性腎障害の後に腎機能が十分に回復せず、慢性腎臓病に移行する危険性が高いですが、そのメカニズムの理解はこれまで不十分でした。
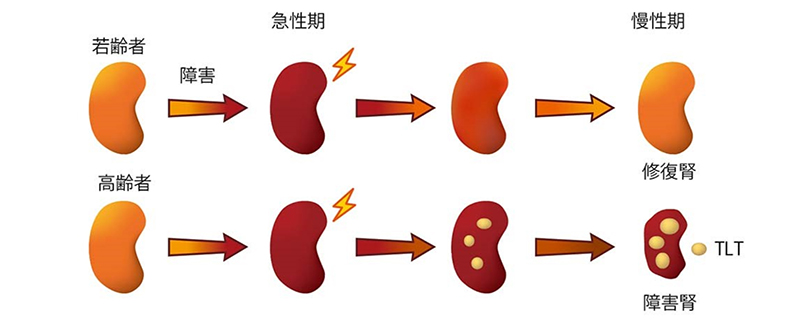
私たちは高齢マウスと若齢マウスの腎臓に虚血再灌流障害を起こすと、高齢マウスでのみ三次リンパ組織という異所性のリンパ組織が形成され、炎症が遷延し、組織修復が不十分になることを見出しました(図1)(Sato Y, Yanagita M, JCI insight 2016)1。三次リンパ組織は主にT細胞、B細胞の集簇と特殊な線維芽細胞の骨格からなること、腎臓の線維芽細胞が腎障害後に特殊な形質を獲得し、それが三次リンパ組織形成の原動力になること、ヒト高齢者でも三次リンパ組織が高頻度に形成することを明らかにし、腎三次リンパ組織形成が種を越えて保存された現象であることを報告しました。
② 三次リンパ組織の成熟度分類作成と、新規腎組織障害マーカーとしての意義の解明
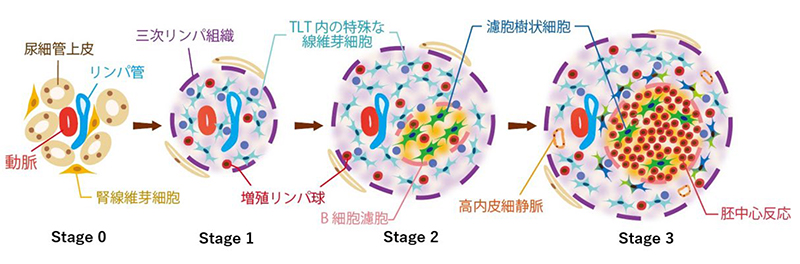
私たちは、三次リンパ組織が3つの段階を経て成熟することを見出し、その病理組織学的stage分類を作成しました(図2)。そのstage分類を用いて解析すると、三次リンパ組織が腎臓の組織障害と炎症を反映していることかが明らかとなり、腎組織障害度の新たなマーカーとなる可能性が示唆されました(Sato Y, Yanagita M, Kidney Int 2020)2。
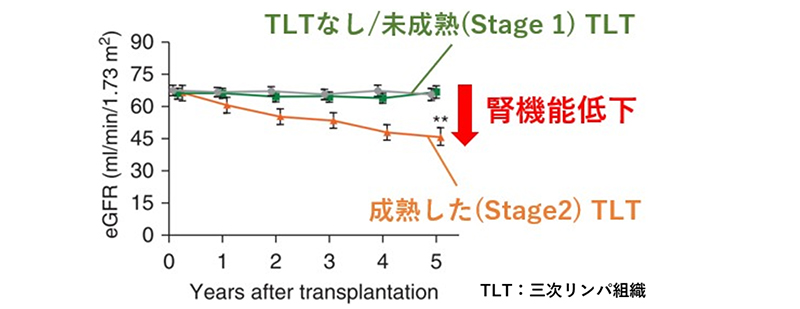
また、私たちは腎移植後のプロトコール腎生検において、成熟した三次リンパ組織が検出されると5年後の腎予後が悪いことを見出し、三次リンパ組織が新たな腎予後予測因子となりうることを報告しました(図3)(Lee YH, Sato Y, Yanagita M, J Am Soc Nephrol 2022)3,4。
③ 三次リンパ組織は老化関連T細胞と老化関連B細胞の相互作用により拡大・成熟する
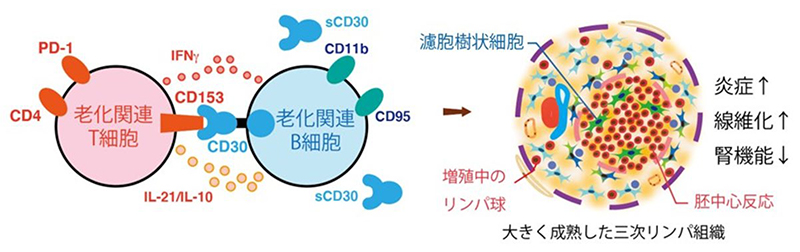
私たちは三次リンパ組織形成障害腎の血球を用いたシングルセル解析を行い、加齢に伴って増加する老化関連T細胞と老化関連B細胞がCD153-CD30経路を介して相互作用することが三次リンパ組織の拡大や腎障害に寄与していることを見出しました(図4)(Sato Y, Yanagita M, J Clin Invest 2022)5。
私たちはこれらの老化リンパ球やCD153-CD30シグナルが腎臓病の新たな治療標的になると考え、現在研究を進めています。
④ 腎三次リンパ組織による炎症増幅と腎修復障害に関わる、血球と腎実質細胞の相互作用の解明
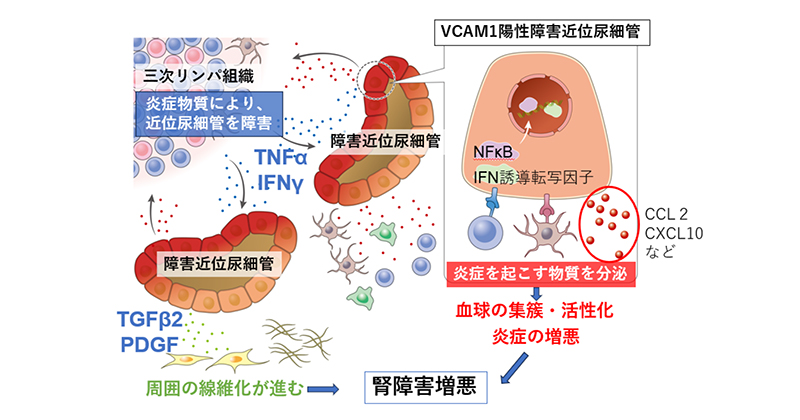
これまでの研究から、三次リンパ組織は高齢者の障害腎臓において有害であることが想定され、さらにIgA腎症やループス腎炎などの腎臓病でも予後不良や疾患活動性との関連が報告されています。しかし、「なぜ三次リンパ組織が腎臓に有害か」に関するメカニズムは不明でした。それを明らかにするため、私たちは高齢マウスの障害腎におけるシングル核解析を施行し、三次リンパ組織周囲に向炎症性質をもつVACM1陽性障害近位尿細管上皮細胞が高頻度に存在することを見出しました(Yoshikawa T, Yanagita M, J Am Soc Nephrol 2023)6。
さらに、三次リンパ組織内部のリンパ球がTNFやIFNを過剰に産生しており、それが周囲の近位尿細管修復を阻害し、向炎症性質を増強すること、また向炎症性質をもつVCAM1陽性障害近位尿細管はCCL2やCXCL10などのケモカイン産生を介して周囲の血球の遊走や活性化を促し、さらにはTGF2やPDGFなどの産生により線維芽細胞を活性化し、炎症と線維化を増悪させることを報告しました(図5)。
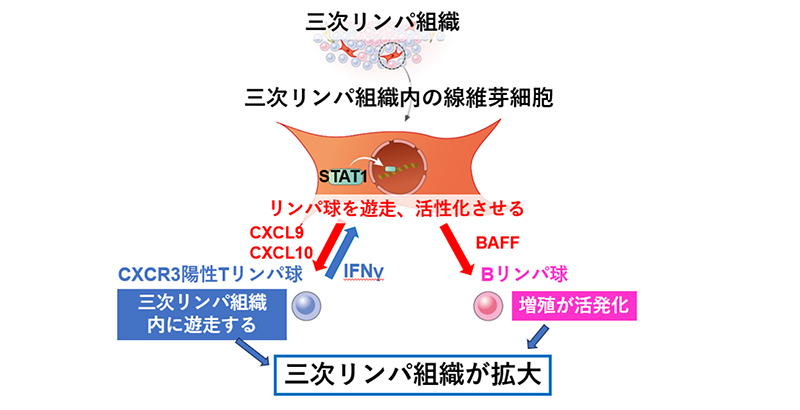
一方、三次リンパ組織内部の向炎症性線維芽細胞は周囲のCXCR3陽性T細胞が過剰に産生するIFNの作用を受け、STAT1依存性にCXCL9、CXCL10、BAFFといったケモカインやサイトカインの産生を亢進させ、リンパ球の遊走や活性化を促し、三次リンパ組織の拡大に寄与することを報告しました(図6)。
このように、向炎症性腎実質細胞と血球の相互作用が三次リンパ組織拡大や腎修復障害の一因であることが分かり、これらの相互作用は今後の新たな治療標的となることが期待されます。
(2) 個体における老化細胞の可視化とその機能の解析
これまでに様々な研究チームから、個体老化ならびに臓器障害に伴って老化細胞が蓄積し、その炎症性形質により微小環境の炎症を増幅させることが報告されてきましたが、老化細胞の可視化については未だ課題があります。
そこで、我々は遺伝子改変モデルマウスを用いた検討により細胞種特異的に老化細胞を検出できる新しい方法を見出し、臓器内における老化細胞の性質とふるまいを解析しています。
参考文献
- Sato Y, Mii A, Hamazaki Y, Fujita H, Nakata H, Masuda K, Nishiyama S, Shibuya S, Haga H, Ogawa O, Shimizu A, Narumiya S, Kaisho T, Arita M, Yanagisawa M, Miyasaka M, Sharma K, Minato N, Kawamoto H, Yanagita M. Heterogeneous fibroblasts underlie age-dependent tertiary lymphoid tissues in the kidney. JCI Insight. 2016;1(11):e87680. doi: 10.1172/jci.insight.87680.
- Sato Y, Yanagita M. Immune cells and inflammation in AKI to CKD progression. Am J Physiol Renal Physiol. 2018;315(6):F1501-F1512. doi: 10.1152/ajprenal.00195.2018.
- Nakamura J, Sato Y, Kitai Y, Wajima S, Yamamoto S, Oguchi A, Yamada R, Kaneko K, Kondo M, Uchino E, Tsuchida J, Hirano K, Sharma K, Kohno K, Yanagita M. Myofibroblasts acquire retinoic acid-producing ability during fibroblast-to-myofibroblast transition following kidney injury. Kidney Int. 2019;95(3):526-539. doi: 10.1016/j.kint.2018.10.017.
- Sato Y, Yanagita M. The unprecedented era of aging. Inflamm Regen. 2019;39:15. doi: 10.1186/s41232-019-0104-2.
- Sato Y, Yanagita M. Immunology of the ageing kidney. Nat Rev Nephrol. 2019;15(10):625-640. doi: 10.1038/s41581-019-0185-9.
- Sato Y, Yanagita M. Functional heterogeneity of resident fibroblasts in the kidney. Proc Jpn Acad Ser B Phys Biol Sci. 2019;95(8):468-478. doi: 10.2183/pjab.95.033.
- Sato Y, Takahashi M, Yanagita M. Pathophysiology of AKI to CKD progression. Semin Nephrol. 2020;40(2):206-215. doi: 10.1016/j.semnephrol.2020.01.011.
- Sato Y, Boor P, Fukuma S, Klinkhammer BM, Haga H, Ogawa O, Floege J, Yanagita M. Developmental stages of tertiary lymphoid tissue reflect local injury and inflammation in mouse and human kidneys. Kidney Int. 2020;98(2):448-463. doi: 10.1016/j.kint.2020.02.023.
- Arai H, Sato Y, Yanagita M. Fibroblast heterogeneity and tertiary lymphoid tissues in the kidney. Immunol Rev. 2021;302(1):196-210. doi: 10.1111/imr.12969.
- Yamamoto S, Yanagita M. A Novel Pathological Mechanism of Tertiary Lymphoid Structure Formation in the Renal Pelvis. J Am Soc Nephrol. 2022;33(1):4-6. doi: 10.1681/ASN.2021111465.
- Lee YH, Sato Y, Saito M, Fukuma S, Saito M, Yamamoto S, Komatsuda A, Fujiyama N, Satoh S, Lee SH, Boor P, Habuchi T, Floege J, Yanagita M. Advanced Tertiary Lymphoid Tissues in Protocol Biopsies are Associated with Progressive Graft Dysfunction in Kidney Transplant Recipients. J Am Soc Nephrol. 2022;33(1):186-200. doi: 10.1681/ASN.2021050715.
- Sato Y, Lee YH, Taniguchi K, Yoshikawa T, Boor P, Floege J, Yanagita M. Authors' Reply: Advanced Tertiary Lymphoid Tissues in Protocol Biopsies in Kidney Transplant Recipients: Addressing Additional Methods To Detect Intragraft B Cells. J Am Soc Nephrol. 2022;33(4):868-869. doi: 10.1681/ASN.2021121588.
- Sato Y, Oguchi A, Fukushima Y, Masuda K, Toriu N, Taniguchi K, Yoshikawa T, Cui X, Kondo M, Hosoi T, Komidori S, Shimizu Y, Fujita H, Jiang L, Kong Y, Yamanashi T, Seita J, Yamamoto T, Toyokuni S, Hamazaki Y, Hattori M, Yoshikai Y, Boor P, Floege J, Kawamoto H, Murakawa Y, Minato N, Yanagita M. CD153/CD30 signaling promotes age-dependent tertiary lymphoid tissue expansion and kidney injury. J Clin Invest. 2022;132(2):e146071. doi: 10.1172/JCI146071.
- Ariyasu Y, Sato Y, Isobe Y, Taniguchi K, Yanagita M. Arita M. Sterol O-Acyltransferase Inhibition Ameliorates High-Fat Diet-Induced Renal Fibrosis and Tertiary Lymphoid Tissue Maturation after Ischemic Reperfusion Injury. Int J Mol Sci. 2022;23(24):15465. doi: 10.3390/ijms232415465.
- Kaneko K, Sato Y, Uchino E, Toriu N, Shigeta M, Kiyonari H, Endo S, Fukuma S, Yanagita M. Lineage tracing analysis defines erythropoietin-producing cells as a distinct subpopulation of resident fibroblasts with unique behaviors. Kidney Int. 2022;102(2):280-292. doi: 10.1016/j.kint.2022.04.026.
- Sato Y, Tamura M, Yanagita M. Tertiary lymphoid tissues: a regional hub for kidney inflammation. Nephrol Dial Transplant. 2023;38(1):26-33. doi: 10.1093/ndt/gfab212.
- Yoshikawa T, Lee YH, Sato Y, Yanagita M. Tertiary lymphoid tissues in kidney diseases: a perspective for the pediatric nephrologist. Pediatr Nephrol. 2023;38(5):1399-1409. doi: 10.1007/s00467-022-05770-4.
- Sato Y, Silina K, van den Broek M, Hirahara K, Yanagita M. The roles of tertiary lymphoid structures in chronic diseases. Nat Rev Nephrol. 2023;19(8):525-537. doi: 10.1038/s41581-023-00706-z.
- Yoshikawa T, Oguchi A, Toriu N, Sato Y, Kobayashi T, Ogawa O, Haga H, Sakurai S, Yamamoto T, Murakawa Y, Yanagita M. Tertiary Lymphoid Tissues Are Microenvironments with Intensive Interactions between Immune Cells and Proinflammatory Parenchymal Cells in Aged Kidneys. J Am Soc Nephrol. 2023 Aug 7. doi: 10.1681/ASN.0000000000000202. Epub ahead of print.