南野 徹
順天堂大学 大学院医学研究科 循環器内科
班員プロフィール

南野 徹
順天堂大学 大学院医学研究科 循環器内科 教授。
1989年千葉大学医学部卒業。臨床研修後、東京大学医学部にて医学博士取得。
ハーバード大学医学部研究員などを経て、2012年より新潟大学大学院医歯学総合研究科循環器内科教授、2020年より順天堂大学大学院医学研究科循環器内科教授。
専門は循環器内科学(動脈硬化や心不全、生活習慣病)。
30年前から細胞老化に関する研究を開始し、現在、老化細胞を標的とした抗老化治療の開発を行っている。
研究内容
老化細胞除去ワクチンの開発
加齢や肥満などの代謝ストレスによって、生活習慣病やアルツハイマー病などの加齢関連疾患が発症・進展することが知られていますが、その仕組みはよくわかっていません。研究グループではこれまで30年以上にわたって加齢関連疾患の発症メカニズムについて研究を進め、加齢やストレスによって組織に老化細胞が蓄積し、それによって惹起される慢性炎症が、加齢関連疾患の発症・進展に関わっていることを明らかにしてきました1-19。さらに最近、蓄積した老化細胞を除去(セノリシス)することで、加齢関連疾患における病的な老化形質を改善しうることが示されています。しかしながら、これまで報告されている老化細胞除去薬は、抗がん剤として使用されているものが多く、副作用の懸念がありました。そこで研究グループは、より老化細胞に選択的に作用し、副作用の少ない治療法の開発を目指して研究を行いました。
本研究ではまず、老化細胞に特異的に発現している老化抗原を同定するために、老化したヒト血管内皮細胞の遺伝子情報を網羅的に解析しました。得られた候補のうち、すでにヒトの老化と関連があることが示唆されているGPNMBという老化抗原について解析を進めました。その結果、GPNMBはヒト老化血管内皮細胞において著明に増加するだけでなく、動脈硬化モデルマウスや高齢マウスの血管や内臓脂肪組織においてもその発現の増加が認められました。また、動脈硬化疾患のある高齢患者の血管においてもその発現が増加していることがわかりました。
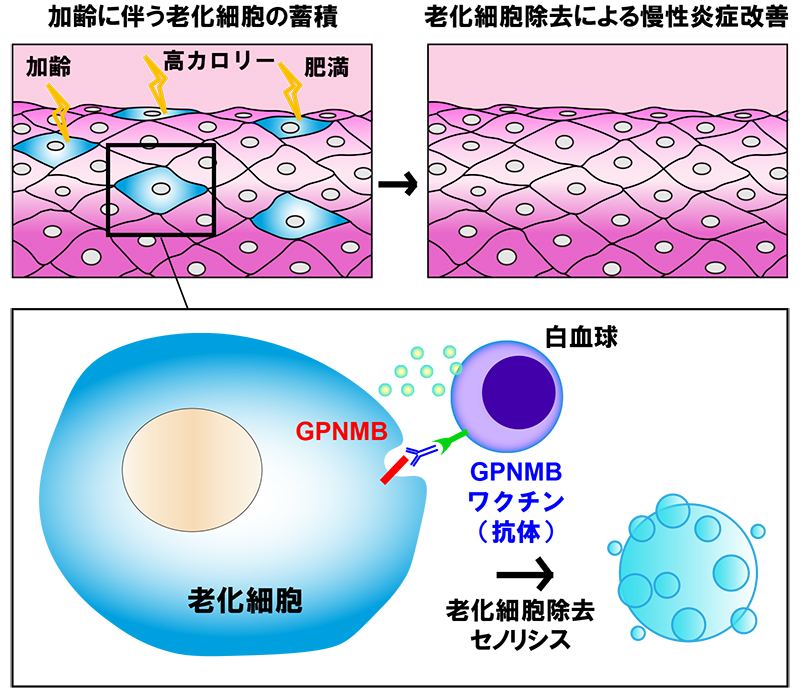
老化細胞除去ワクチンによって誘導される抗体による免疫反応により、老化細胞が選択的に除去(セノリシス)され、慢性炎症が改善する。
次に、GPNMBを標的とした抗老化治療の可能性を検証するため、GPNMB陽性の老化細胞を薬剤によって選択的に除去できる遺伝子改変モデルマウスを作製しました。そのマウスに肥満食を与えたうえで、薬剤によりGPNMB陽性老化細胞の選択的除去を行ったところ、肥満に伴う糖代謝異常や動脈硬化の改善が認められることがわかりました。
そこで、GPNMBを標的とした老化細胞除去ワクチンの開発に取り組みました(図1)。いくつかデザインしたワクチンの中で、接種にてGPNMBに対する抗体価が有意に増加するものを選別しました。このワクチンを肥満食を与えた状態のマウスに接種したところ、肥満に伴って内臓脂肪に蓄積した老化細胞が除去され、脂肪組織における慢性炎症が改善することで、糖代謝異常の改善が得られることがわかりました。また、動脈硬化モデルマウスでは動脈硬化巣において多くの老化細胞の蓄積が見られましたが、老化細胞除去ワクチンによって老化細胞は除去され、慢性炎症の改善とともに動脈硬化巣を縮小させうることがわかりました。さらに、高齢マウスにおけるワクチン接種後のフレイルの状態を観察したところ、ワクチン接種していないマウスと比較してフレイルの進行が抑制されていました。早老症モデルマウスに対するワクチン接種では、寿命の延長効果が確認されました(図2)。最後にこれまでの老化細胞除去薬との比較実験では、老化細胞除去ワクチンの副作用が少ないことや効果の持続時間が長いことなども確認できました。
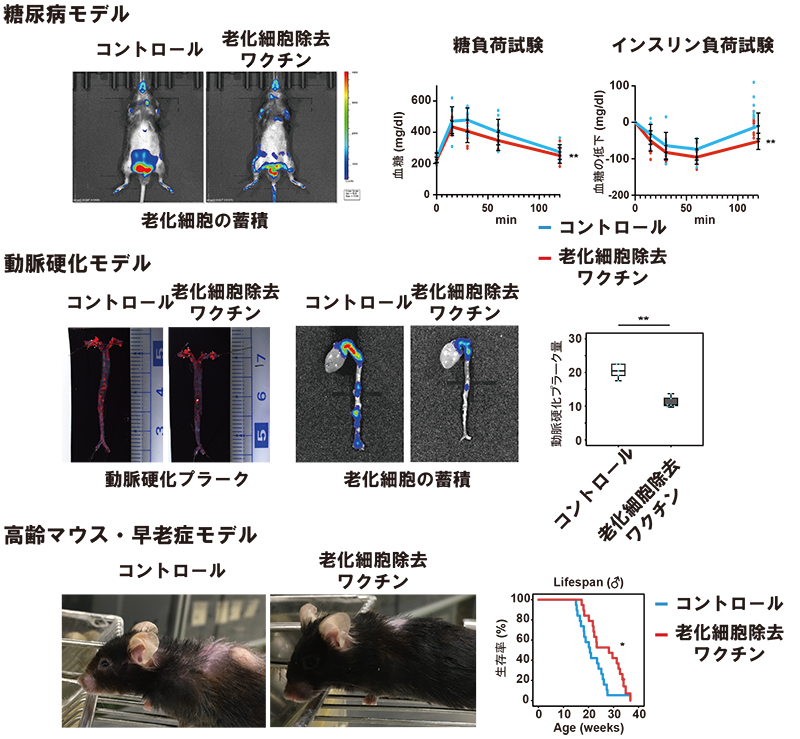
老化細胞除去ワクチンによって肥満に伴う糖尿病や動脈硬化、加齢に伴うフレイルの改善、早老症マウスの寿命の延長が認められた。
以上の結果から、GPNMBなどの老化抗原を標的とした老化細胞除去ワクチンは、加齢関連疾患に対する新しい治療方法となりうることが期待されます20,21。
今回、研究グループは、加齢関連疾患に対する新しい治療法の確立に向けた老化細胞除去ワクチン開発に成功しました。GPNMBは老化した血管内皮細胞や単球に豊富に発現している老化抗原ですが、他種の老化細胞では別の老化抗原が存在することが予想されます。今後は、各々の患者や疾患によって蓄積している老化細胞の異なる老化抗原を標的とすることで、個別化抗老化医療の実現が可能になると考えられます。本研究では、糖尿病や動脈硬化、フレイルに対する改善効果や早老症に対する寿命延長効果を確認できたことで、今後はアルツハイマー病を含めた様々な加齢関連疾患での検証や、ヒトへの臨床応用が期待されます。
参考文献
- Shimizu, I. et al. Excessive cardiac insulin signaling exacerbates systolic dysfunction induced by pressure overload in rodents. J Clin Invest 120, 1506-1514, doi:40096 [pii]10.1172/JCI40096.
- Minamino, T. et al. Endothelial cell senescence in human atherosclerosis: role of telomere in endothelial dysfunction. Circulation 105, 1541-1544 (2002).
- Minamino, T. et al. Ras induces vascular smooth muscle cell senescence and inflammation in human atherosclerosis. Circulation 108, 2264-2269 (2003).
- Minamino, T., Miyauchi, H., Tateno, K., Kunieda, T. & Komuro, I. Akt-induced Cellular Senescence: Implication for Human Disease. Cell Cycle 3, 449-451 (2004).
- Minamino, T. et al. Vascular cell senescence and vascular aging. J Mol Cell Cardiol 36, 175-183 (2004).
- Miyauchi, H. et al. Akt negatively regulates the in vitro lifespan of human endothelial cells via a p53/p21-dependent pathway. Embo J 23, 212-220 (2004).
- Kunieda, T. et al. Cellular senescence impairs circadian expression of clock genes in vitro and in vivo. Circ Res 98, 532-539 (2006).
- Kunieda, T. et al. Angiotensin II induces premature senescence of vascular smooth muscle cells and accelerates the development of atherosclerosis via a p21-dependent pathway. Circulation 114, 953-960 (2006).
- Minamino, T. & Komuro, I. Vascular cell senescence: contribution to atherosclerosis. Circ Res 100, 15-26 (2007).
- Sano, M. et al. p53-induced inhibition of Hif-1 causes cardiac dysfunction during pressure overload. Nature 446, 444-448 (2007).
- Minamino, T. & Komuro, I. Vascular aging: insights from studies on cellular senescence, stem cell aging, and progeroid syndromes. Nat Clin Pract Cardiovasc Med 5, 637-648, doi:ncpcardio1324 [pii]10.1038/ncpcardio1324 (2008).
- Minamino, T. et al. A crucial role for adipose tissue p53 in the regulation of insulin resistance. Nat Med 15, 1082-1087, doi:nm.2014 [pii]10.1038/nm.2014 (2009).
- Orimo, M. et al. Protective Role of SIRT1 in Diabetic Vascular Dysfunction. Arterioscler Thromb Vasc Biol, doi:ATVBAHA.109.185694 [pii]10.1161/ATVBAHA.109.185694 (2009).
- Shimizu, I. et al. p53-induced adipose tissue inflammation is critically involved in the development of insulin resistance in heart failure. Cell Metab 15, 51-64, doi:10.1016/j.cmet.2011.12.006 (2012).
- Shimizu, I. et al. Semaphorin3E-induced inflammation contributes to insulin resistance in dietary obesity. Cell Metab 18, 491-504, doi:10.1016/j.cmet.2013.09.001 (2013).
- Shimizu, I., Yoshida, Y., Suda, M. & Minamino, T. DNA damage response and metabolic disease. Cell Metab 20, 967-977, doi:10.1016/j.cmet.2014.10.008 (2014).
- Yokoyama, M. et al. Inhibition of endothelial p53 improves metabolic abnormalities related to dietary obesity. Cell Rep 7, 1691-1703, doi:10.1016/j.celrep.2014.04.046 (2014).
- Yoshida, Y. et al. p53-Induced inflammation exacerbates cardiac dysfunction during pressure overload. J Mol Cell Cardiol 85, 183-198, doi:10.1016/j.yjmcc.2015.06.001 (2015).
- Yokoyama, M. et al. p53 plays a crucial role in endothelial dysfunction associated with hyperglycemia and ischemia. J Mol Cell Cardiol 129, 105-117, doi:10.1016/j.yjmcc.2019.02.010 (2019).
- Suda, M. et al. Glycoprotein nonmetastatic melanoma protein B regulates lysosomal integrity and lifespan of senescent cells. Sci Rep 12, 6522, doi:10.1038/s41598-022-10522-3 (2022).
- Suda, M. et al. Senolytic vaccination improves normal and pathological age-related phenotypes and increases lifespan in progeroid mice. Nat Aging 1, 1117-1126, doi:10.1038/s43587-021-00151-2 (2021).